癌性疼痛常用药的正确使用
张 玲麻醉药品指作用于神经中枢,兴奋受体激活内源性镇痛系统的药品,连续使用、滥用、不合理使用可产生依赖性成瘾癖。如强迫性非医疗性用药。癌症镇痛最常用的麻醉药品有阿片类(吗啡、羟考酮、芬太尼、可待因)以及非阿片类——曲马多[1-4]。

据报道,2015年我国吗啡的总消耗量为19.6吨,居世界排名第88位。我国医疗用阿片类药物消耗量处于世界低水平。我国自2011年起开展了癌痛规范化治疗示范病房(GPM)活动以来,相关医护人员对癌痛的认知和治疗水平都有了很大提高,但不可否认的是,仍然有很多患者的镇痛要求没有得到满足。统计显示,约40%的癌症疼痛患者没有得到有效的镇痛治疗,生活质量差。吗啡类药物使用镇痛效果差的原因有政府管控、医师原因、患者对于癌痛的认识不足、癌痛治疗知识匮乏、经济因素、种族信仰不同 、害怕依赖、疗效不佳或不良反应、药物滥用等。 在加强监管力度的同时提高麻醉药品的规范化治疗,合理用药应增强镇痛效果、减轻不良反应、降低成瘾性、最大限度地减轻患者痛苦。“管得住,用得上”,达到最大程度镇痛、最小不良反应、最佳躯体和心理功能、最好的生活质量和生活满意度的为目的。
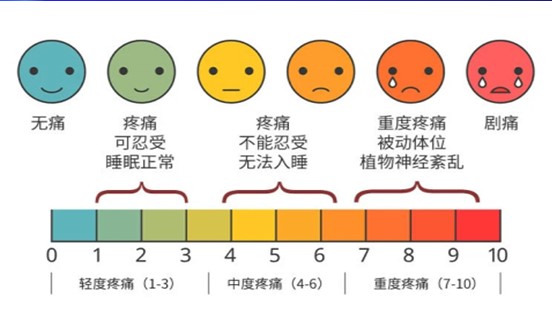
|
| 图1 面部表情疼痛评分量法 |
癌性疼痛(以下简称癌痛)可引起心率呼吸加快、血压上升、 烦躁不安、胃肠道功能降低、促进血栓形成,是继体温、脉搏、呼吸、血压之后的第五生命体征。2019年3月在中国正式实施的第11版国际疾病分类(ICD-11)中,将“慢性癌性疼痛”列为独立病种。自2011年起每年发布《癌痛诊疗规范》[2],以2018版指导性较为全面。规范化镇痛治疗,首先应对疼痛进行诊断与评估:(1)常规评估原则:主动询问有无疼痛。(2)量化评估原则:①数字分级法(NRS);②面部表情疼痛评分量法(见表1);③主诉疼痛程度分级法(VRS)。(3)全面评估原则:疼痛及相关病情。(4)全面评估原则:①疼痛病因和类型:躯体性、内脏性或神经病理性;②疼痛发作情况:疼痛的部位、性质、程度、加重或减轻的因素;③止痛治疗情况、重要器官功能情况、心理精神情况,家庭及社会支持情况以及既往史(如精神病史,药物滥用史)等。(5)动态评估:疼痛病因、部位、性质、程度变化情况、爆发性疼痛发作情况、疼痛减轻和加重因素,止痛治疗的效果以及不良反应等。

疼痛按病理生理学机制分为伤害感受性躯体痛:钝痛、锐痛、压迫性疼痛,定位准确;内脏痛:弥漫性疼痛和绞痛,定位不够准确;神经病理性疼痛:刺痛、烧灼样痛、放电样痛、枪击样疼痛、麻木痛、麻刺痛等。
根据世界卫生组织(World Health Organization,WHO)《癌痛三阶梯镇痛治疗指南》和《美国国立综合癌症网络成人癌痛临床实践指南(2019.V3)》,癌痛药物镇痛治疗的5项基本原则改进如下用药原则:(1)首选无创、口服给药。外用芬太尼透皮贴;口服即释片吗啡 、羟考酮及其缓释剂型;WHO最新癌痛管理指南——关注镇痛药物的充分性和可及性:必须为所有需要的患者提供即释吗啡,在可能的情况下,应提供缓释吗啡作为即释口服吗啡的补充,而不是替代。(2)按阶梯给药:轻度疼痛(评分1~3分)可选用NSAID或对乙酰氨基酚以及辅助镇痛药物(抗惊厥类药物、抗抑郁类药物、糖皮质激素、局部麻醉药物和双膦酸盐类药物等);中度疼痛(评分4~6分)可选用弱阿片类药物或低剂量的强阿片类药物,可联合应用NSAID或对乙酰氨基酚以及辅助镇痛药物(抗惊厥类药物、抗抑郁类药物、糖皮质激素、局部麻醉药物和双膦酸盐类药物等);重度疼痛(评分7~10分):首选强阿片类药物,并可合用NSAID或对乙酰氨基酚以及辅助镇痛药物(抗惊厥类药物、抗抑郁类药物、糖皮质激素、局部麻醉药物和双膦酸盐类药物等)。(3)按时给药:吗啡缓释片 q12 h/次,芬太尼缓释透皮贴 q72 h/次,丁丙诺啡透皮贴 qw/次。(4)个体化给药:应按照患者具体病情和个体化差异,使用合适的药物、剂量和给药途径使疼痛得到充分缓解,制订个体化用药方案剂量,方法是给予即释片吗啡5~15 mg,口服,q4 h或按需给药;用药后疼痛不缓解或缓解不满意,应于1 h后根据疼痛程度给予滴定剂量第1天治疗结束后,计算次日药物剂量:次日总固定量=前24 h总固定量+前日总滴定量。次日治疗时,将计算所得的次日总固定量分6次口服,次日滴定量为前24 h总固定量的10%~20%。依法逐日调整剂量,直到疼痛评分稳定在0-3分。(5)注意具体细节:一般情况下阿片剂量可按照10%~25%/d的剂量减少,直到每天剂量相当于30 mg口服吗啡的药量,再继续服用2 d后即可停药。对使用镇痛药物的患者要加强监护,密切观察其疼痛缓解程度和不良反应发生情况,注意药物联合应用的相互作用和配伍禁忌,以便在镇痛药物疗效和不良反应之间取得平衡。
调整药物剂量阿片类缓释制剂起始基础剂量一般口服缓释吗啡10~20 mg(已服用过弱阿片类30 mg)或缓释盐酸羟考酮10~20 mg,每12 h给药1次)。剂量增减的25%~50%,最多不超过100%。不良反应需调整药物剂量时,应首先停药1~2次,再将剂量减少50%~70%,然后加用其他种类的镇痛药。阿片类药物剂量换算表见表1。
| 表1 阿片类药物剂量换算表 | |||
| 药物 | 非胃肠给药 | 口服 | 等效剂量 |
|---|---|---|---|
| 吗啡 | 10 mg | 30 mg | 非胃肠道:口服=1:3 |
| 可待因 | 130 mg | 200 mg |
非胃肠道:口服=1:1.2 吗啡(口服):可待因(口服)=1:6.5 |
| 羟考酮 | 10 mg | 20 mg | 吗啡(口服):羟考酮(口服)=l.5-2:1 |
| 芬太尼透皮贴剂 | 25μg/h(透皮吸收) | 芬太尼透皮贴剂μg/h,q72h剂量=1/2×口服吗啡 mg/d剂量 | |
| 曲马多 | 100 mg | 300 mg | 非肠道∶口服= 1 ∶ 3 |
逐渐停用有反应的药物:在应用长效阿片类药物期间,应备用短效阿片类药物(如吗啡口服即释剂、羟考酮口服即释剂、吗啡或羟考酮注射剂等)作为解救药物治疗爆发痛,爆发痛解救剂量为前24 h用药总量的10%~20%。每日短效阿片解救用药次数≥ 3次时,应考虑将前24 h解救用药剂量换算成长效阿片类药物按时给药。
不良反应防治。 便秘:乳果糖、聚乙二醇、麻仁丸。恶心、呕吐:胃复安、氟哌啶类镇静、5-HT3。皮肤瘙痒:苯海拉明、西替利嗪。呼吸抑制:1 ml纳洛酮(0.4 mg/ml)加入生理盐水稀释至10 ml,每30~60 s静脉给药1~2 ml,直至症状改善,必要时重复给药,如果10 min内仍无效且纳洛酮给药总量达到1 mg,需重新评估呼吸抑制的原因及其严重程度。协同镇痛药:抗惊厥类药物苯妥英钠治疗刀割痛、射击痛。三环类类药物:抗抑郁如加巴喷丁、卡马西平。镇静催眠药用于病理神经性疼痛。钙通道阻滞药:尼莫地平调节阿片类药物的耐受性。可乐定:可抑制脊髓伤害性神经元释放P物质在脊髓不平的突触前和突触后阻断伤害性感觉信息的传递。
吗啡消耗量也是国际上评价国民镇痛疗效水平的金标准, 因其疗效确切,效果好,价格低,吗啡是中重度癌痛治疗的首选药,药物经济学成本效果比为13.40,副作用研究充分,副作用与同类药品相当,剂量大小可根据癌痛程度及时调整,且无天花板效应。
羟考酮是NCCN成人癌痛指南推荐的癌痛治疗的首选用药之一,其等效止痛作用强度为吗啡的1.5倍,缓控释制剂在体内呈双相吸收峰,38%的即释部分可在1 h内快速起效,62%的缓释部分可维持患者血药浓度,持续12 h镇痛。羟考酮缓释片药物经济学成本-效果比为16.12,价格相对吗啡较偏高。
芬太尼透皮贴是一种无创的新型阿片类药物,其能避免首关效应及胃肠道系统药物不良反应,同时还为吞咽困难、意识障碍等患者提供了有效的给药途径。但是价格相对较高,剂量不宜调整,且吸收过程容易受到干扰,不被临床推荐为首选药物。粘贴前用清水清洁,每次需更换粘贴部位掌压30 s以上,起始量25 μg/h, 72 h更换一次 ,镇痛效果不理想时加用短效镇痛药(吗啡片、羟考酮片),调整剂量一般以25 μg/h梯度增加或降低,当达300 μg/h仍不能控制疼痛,视为无效。
哌替啶为吗啡的代用品,副作用和成瘾性较吗啡低。其代谢物去甲哌替啶的N毒性很强,且血浆半衰期长,代谢缓慢,长期应用后强体内产生蓄积,致战栗、震颤等神经毒性,WHO提出不宜用于癌性疼痛等慢必疼痛的治疗。
目前,人工合成芬太尼其他制剂广泛用于临床手术麻醉镇痛,但注射用药4 h后存在延迟性呼吸抑制,其中瑞芬太尼副作用相对少,使用不受年龄、性别、肝肾功能的限制,代谢快无蓄积等特点。但其制剂不含防腐剂但有甘氨酸,不适于硬膜外和鞘内麻醉。二氢埃托啡镇痛作用的量效关系与吗啡一样呈直线型依赖性大,只可含化不可将药片吞服,否则影响止痛效果。过量致中毒时应及时进行人工呼吸,必要时可肌注或静注盐酸纳洛酮0.4 mg或氢溴酸烯丙吗啡10 mg解救。非阿片类镇痛药曲马多 作用强度约为吗啡的1/10,不良反应有消化道不适、眩晕、疲倦等 。长期应用时可有一定程度的潜在耐药性和成瘾性。应用时应注意。
[1] 卫生部.卫生部麻醉药品临床应用指导原则[S].[2007]38号. 2007-01-25
[2] 国家卫生健康委.癌痛诊疗规范[S]. 国卫办医函〔2018〕734号.2018-10-02
[3] 江苏省肿瘤科医疗质量控制中心.江苏省成人癌症疼痛诊疗规范[J]. 中国医学前沿杂志(电子版),2020,12(6):28.
[4] 卢晓阳主编.医院处方点评规范化操作手册[M].北京:人民卫生出版社,2019:1.