七氟烷对患者术后认知功能的影响
李志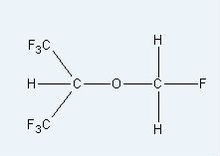
| 七氟烷分子结构式 |
术后认知功障碍(POCD),是指术前无精神障碍的患者,受到围术期各种因素的影响,手术麻醉后数日发生学习与记忆能力、语言能力、定向能力、思维和睡眠等方面的紊乱,是一种可逆的、具有波动性的急性精神紊乱综合征[1]。其症状可持续至术后数周或数月,少数人甚至长期存在,增加术后并发症的发生率,延长住院时间,延迟患者术后康复[2]。
动物实验和临床研究均显示吸入麻醉药影响认知功能。与其他吸入麻醉药相比,七氟烷临床应用更为广泛,七氟烷作为一种短时效的吸入麻醉药,主要通过抑制N⁃甲基⁃D⁃天冬氨酸(NMDA)受体发挥作用,其血/气分配系数仅为0.63,麻醉诱导和术后苏醒均非常迅速[3]。然而,目前关于七氟烷对认知功能的影响的研究尚缺乏一致意见。现将部分研究结果分析如下。
一些研究报道称七氟醚麻醉诱导能在麻醉后24h改善成年小鼠的认知能力[4],其机制可能与p-ERK1/2上调,NR2B表达增加有关。
NMDA受体和其下游的信号通道在学习和记忆中发挥非常重要的作用。细胞外信号调节激酶1和2(ERK1/2)是NMDA受体活化的主要下游参与者。上调磷酸化ERK1/2能够促进神经元存活,反之,下调则导致神经变性。据报道显示,七氟烷能够抑制海马组织中ERK1/2的磷酸化[5]。
众所周知,海马区在学习和记忆中占有重要地位,也是药物调控认知过程的重要靶点。海马区NR2B和ERK1/2的表达与海马依赖的空间学习和记忆任务密切相关。在成人大脑的海马和组织的新皮质,NR2A 和 NR2B均是优势NR2亚基。突触亚基NR2A和突触外亚基NR2B之间的平衡决定了神经元的命运[6]。NR2B数目增加与神经元死亡、神经变性直接相关。当NR2A受到抑制而NR2B同时被激活时,能够使NMDA受体发生由神经保护到兴奋性中毒的角色转变[7]。此外,NR2B也是增强记忆和发挥长时程增强作用(LTP)的靶点。NR2B的活化被认为是修饰突触可塑性、加强学习和记忆的可行策略[8]。在转基因鼠中NR2B亚基的过度表达与增加NMDA受体活化、改善学习和记忆直接相关。在大鼠齿状回长时程增强作用的显现与增加的NR2B水平直接相关[9]。Liu等[5]的研究数据显示,增加的NR2B水平在记忆增强,同时在改善空间认知方面的有益作用。同时,鉴于患者在吸入七氟醚后认知行为的改善,他们认为NR2B和下游信号分子在七氟醚改善小鼠空间学习和记忆方面可能扮演重要角色。无独有偶,Wang等[10]也同样报道了七氟烷可以选择性地抑制新生大鼠NMDA受体NR2A突触亚基的表达,增加NR2B的表达。
Liu等[5]的研究中七氟烷治疗后p-ERK1/2的定量水平是上调的。尽管p-ERK1/2上调与已经报道的七氟烷治疗后会抑制ERK1/2磷酸化互相矛盾 [10]。然而,考虑到七氟烷增加NR2B的表达,并且,NR2B亚基既能积极地,又能消极地按照发育不同的阶段活化大鼠神经元ERK信号[11],因而,七氟烷治疗后p-ERK1/2表达上调和NR2B表达增加共存似乎是合理的。p-ERK1/2能够激活特异的转录因子,调整关键突触蛋白的表达水平和功能[12]。而增加的p-ERK1/2能够促进神经元的生长和存活。这个过程对多种形式的突触可塑性均产生影响,包括长时程增强作用(LTP)、长时程抑制(LTD)、学习和记忆的细胞模型等。因而,七氟烷介导的p-ERK1/2表达上调与改善空间认知功能直接相关。同时,七氟醚持续吸入达4 h能够抵消小鼠海马组织中NR2B增强表达和p-ERK1/2上调对认知功能的促进作用,显现出神经毒性。

有研究表明,在缺氧前、缺氧期间单纯吸入高浓度七氟烷可以明显改善缺氧无糖损伤所致的神经电生理改变[13],从而降低因缺氧造成的大脑功能异常。七氟烷预处理海马脑片30min内即可迅速产生明显的脑保护作用,也许能减轻因低血氧造成的脑损伤[14]。这种保护作用可能与其增加脑血流量,增加颅内压,并且降低脑耗氧量的药理学效应有关。而海马是脑组织中对缺氧最为敏感的部位之一,且又与认知功能密切相关,因此,七氟烷可能通过上述机制能够降低术后认知功能障碍的发生率。也有文献报道,对30例髋关节手术的老年患者的研究表明,与椎管内麻醉相比,七氟烷吸入麻醉没有增加术后认知功能降低的的风险[15]。
此外,也有研究报道了七氟烷的神经毒性和对认知能力损伤主要集中在新生小鼠[16,17]。其可能的机制可能与细胞凋亡蛋白酶-3被激活,海马组织的长时程抑制(LTD)被易化以及和Syt1的表达受到抑制有关。
综上,七氟烷是一种新型吸入麻醉药,具有理化性质稳定,血液和组织溶解度低,麻醉深度容易控制,恢复苏醒快而彻底等优点广泛应用于临床。而其对术后认知功能的影响与吸入药浓度、持续吸入时间、是否合并使用其他辅助药物等诸多因素有关,临床实践中应当坚持个体化的选药原则,权衡利弊。
[1] Rasmussen LS,Johnson T,Kuipers HM,et al. Does anaesthesia cause postoperative cognitive dysfunction? A randomized study of regional versus general anaesthesia in 438 elderly patients[J]. Acta Anaesthesiol Scand,2003,47(3):260⁃266.
[2] Wang W,Wang Y,Wu H,et al. Postoperative cognitive dysfunction:current developments in mechanism and prevention[J]. Med Sci Monit,2014,20:1908⁃1912.
[3] 徐晖,戴体俊. 七氟烷的临床应用进展[J]. 国际麻醉学与复苏杂志,2009,30(1):63~66.
[4] Haseneder R, Starker L, Berkmann J, et al. Sevoflurane Anesthesia Improves Cognitive Performance in Mice, but Does Not Influence In Vitro Long-Term Potentation in Hippocampus CA1 Stratum Radiatum[J]. PLoS One,2013, 8(5):e64732.
[5] Hardingham GE, Bading H. Synaptic versus extrasynaptic NMDA receptor signalling: implications for neurodegenerative disorders[J]. Nat Rev Neurosci,2010,11: 682–696.
[6] Liu J, Zhang X, Zhang W, et al. Effects of Sevoflurane on Young Male Adult C57BL/6 Mice Spatial Cognition[J]. PLoS One,2015, 18(8):e0134217.
[7] Liu Y, Wong TP, Aarts M, et al. NMDA receptor subunits have differential roles in mediating excitotoxic neuronal death both in vitro and in vivo[J]. Neurosci, 2007, 27: 2846–2857.
[8] Collingridge GL, Volianskis A, Bannister N, et al. The NMDA receptor as a target for cognitive enhancement[J]. Neuropharmacology,2013,64: 13–26.
[9] Ma H, Yao L, Pang L,et al.Tetrandrine ameliorates sevoflurane‑induced cognitive impairment via the suppression of inflammation and apoptosis in aged rats[J]. Mol Med Rep, 2016,13(6):4814-4820.
[10] Wang WY, Jia LJ, Luo Y, et al. Location- and Subunit-Specific NMDA Receptors Determine the Developmental Sevoflurane Neurotoxicity Through ERK1/2 Signaling[J]. Mol Neurobiol,2016,53(1):216-230.
[11] Sava A, Formaggio E, Carignani C, et al. NMDA-induced ERK signaling is mediated by NR2B subunit in rat cortical neurons and switches from positive to negative depending on stage of development[J]. Neuropharmacology,2012, 62: 925–932.
[12] Mao L, Tang Q, Samdani S, et al. Regulation of MAPK/ERK phosphorylation via ionotropic glutamate receptors in cultured rat striatal neurons[J]. Eur J Neurosci, 2004, 19: 1207–1216.
[13] Xie Z, Culley DJ, Dong Y, et al. The common inhalation anesthetic isoflurane induces caspase activation and increases amyloid beta-protein level in vivo[J]. Ann Neurol,2008,64: 618–627.
[14] Zhang X, Xue Z, Sun A. Subclinical concentration of sevoflurane potentiates neuronal apoptosis in the developing C57BL/6 mouse brain[J]. Neurosci Lett, 2008,447: 109–114.
[15] Nabavi S, Fox R, Proulx CD,et al. Engineering a memory with LTD and LTP[J]. Nature,2014,511: 348-352.
[16] Fang F, Xue Z, Cang J. Sevoflurane exposure in 7-day-old rats affects neurogenesis, neurodegeneration and neurocognitive function[J]. Neurosci, 2012,28: 499–508.
[17] Feng X, Liu JJ, Zhou X, et al. Single sevoflurane exposure decreases neuronal nitric oxide synthase levels in the hippocampus of developing rats[J]. Br J Anaesth,2012, 109:225–233.