紫杉烷类新制剂比较
刘乾前目前紫杉烷类制剂临床上有紫杉醇(paclitaxel)、多西他赛(docetaxel)和卡巴他赛(cabazitaxel)。紫杉醇和多西他赛分别于1992和1998年通过美国FDA批准上市;卡巴他塞于2010年6月17日在美国被批准上市,用于治疗男性前列腺癌。由于紫杉烷类药物水溶性极差,口服吸收困难,临床均注射给药。而为了制成注射剂,3种药物均使用了聚氧乙基蓖麻油或吐温80为助溶剂。但这些助溶剂有两大缺点:一是具有强烈的致敏性,二是均为P-糖蛋白(P-gP)抑制剂。对于致敏性,药学专家们可以在给患者注射这些药物前,通过预施糖皮质激素和H-受体拮抗药予以基本消除;但是对于P-糖蛋白(P-gP)抑制剂的问题,药学专家们总体重视程度不够。
虽然这类药物抗癌谱广、疗效确切,应用也十分广泛,但却难掩助溶剂导致的毒性弊端。为减少助溶剂带来的毒性,药学专家一直在从两方面寻找紫杉烷类水溶性制剂:其一是制成水溶性前药,其二则是做成纳米制剂。前者的尝试几乎完全失败,后者似乎有一些进展。韩国有两家药企也试图将紫杉醇制成口服制剂,其基本思想是将紫杉醇与P-gP抑制剂联用,试图使紫杉醇通过肠壁进入血液。资料显示,韩国大化(Daehwa)制药的DHP107于2013年3月进入3期临床试验,2015年8月结束。截止2018年8月3日,Pharmaprojects网站显示,该产品在南韩状态为“Registered”,Daehwa公司网站上亦未显示该品上市。另一家开发紫杉醇口服制剂的是Hammi公司,商品名为Oraxol,与P-gP抑制剂HM30181联用。该公司2012年2月22日预计该品将在2015年上市,2014年3月19日将上市日期推至2016年,可至今仍未上市。该公司公布的2期临床试验结果显示,主要终点未达到。

目前上市的紫杉烷类纳米制剂有3个:
(1)紫杉醇脂质体(南京绿叶,商品名力扑素);
(2)紫杉醇胶束;
(3)紫杉醇白蛋白。
多西他赛胶束1个。
该品于2003年在中国(目前唯一上市的国家)上市。患者须预先注射糖皮质激素,服用H-受体拮抗药。其给药剂量以及给药时间仍与施贵宝的泰素(Taxol,紫杉醇,Paclitaxel)相同。
目前紫杉醇胶束注册企业1家,上市企业2家,多西他赛胶束上市企业1家。
(1)印度SPARC公司研发的纳米紫杉醇制剂PICN,2014年在印度注册,但截至2018年7月该公司网站显示,该药仍未进入市场。
(2)瑞典Oasmia开发的紫杉醇胶束Paclical,2006年分别获EMA和FDA孤儿药认定(见pharmaprojecs);2013年10月在白俄罗斯、保加利亚、克罗地亚和比利时完成3期临床试验;据称2015年在俄罗斯和哈萨克斯坦上市。2017年公司年报称将在若干国家进行3期临床试验,2018年年报称正在与哈萨克斯坦洽谈上市事宜(见pharmaprojects)。该公司2015年10月在美国上市,受黄馨祥博士购买韩国Samyang公司紫杉醇胶束利好带动,股票最高到达5美元。2016年黄馨祥博士关于开发紫杉醇胶束不利消息传出后,股票一路下跌至现在的1.5美元。
(3)韩国Samyang公司的Cynviloq仅在韩国进入市场。从2007年在韩上市以来,沉寂了多年,股票一直不振。直到2015年5月份,CynviloqTM与Abraxane®的关键性BE结果公布。5月底紫杉醇白蛋白发明人黄馨祥博士携13亿美元巨款买断Cynviloq美国市场后,Samyang名气大涨。1年后黄馨祥博士放弃CynviloqTM开发,致使其新成立的NantHealth公司股票从300多美元大跌至3美元多。该品的副作用无从得知,但患者仍须预先注射糖皮质激素等抗过敏药。从黄馨祥博士放弃的动机上分析,起码他认为胶束不能超过白蛋白,甚至不能超过泰素,因此毫无市场竞争能力。
(4)多西他赛胶束也是由韩国Samyang公司开发且仅在韩国上市,患者亦须预先注射糖皮质激素等抗过敏药,其副作用暂不能确定。
Abraxane于2005年在美国上市,由于患者无须预先注射糖皮质激素等抗过敏药而大受市场青睐。2010年,Abraxane发明人黄馨祥博士以29亿美元将该品卖给新基公司。尽管Abraxane不含聚氧乙基蓖麻油,没有严重过敏反应(无须预先注射糖皮质激素等),但由于在制剂过程中,白蛋白不可避免地会发生空间结构改变,因而进入体内后可能会产生其他副作用。Abraxane与施贵宝的紫杉醇注射剂泰素(Taxol)均在规范市场上市,因而有明确的比较研究。下面将已公布的Abraxane与Taxol相比更为严重的副作用列出,以供参考。
(1) 因不良反应致用药剂量减少发生率:在上市后的关键试验CA031中[1],1052例晚期非小细胞肺癌(NSCLC)患者以1:1的比例随机分为2组,即每周1次Abraxane(100 mg/m2)+每3周1次卡铂(AUC=6mg•min/ml)组(n=521)和每周1次Taxol (200 mg/m2) +每3周1次卡铂(AUC=6 mg•min/ml)组(n=531),最终1038名患者纳入统计。
结果表明,与Taxol相比,Abraxane的不良反应致永久停药的发生率与Taxol相同,均为16%;但不良反应致用药剂量减少的发生率高于Taxol。详见表1。
| 表1 Abraxane(100 mg/m2)或Taxol(200 mg/m2) 与卡铂联用因不良反应致用药剂量减少发生率的比较 | ||
| 项目 | 发生率(%) | |
|---|---|---|
| Abraxane(100 mg/m2) +carboplatin(AUC=6 mg•min/ml) |
Taxol(200 mg/m2) +carboplatin(AUC=6 mg•min/ml) |
|
| 永久停药 | 16 | 16 |
| 较少剂量 | ||
| 中性粒细胞减少 | 24 | 9 |
| 血小板减少 | 13 | 4 |
| 贫血 | 6 | |
| 外周感觉神经病变 | ||
Abraxane外周感觉神经毒性比Taxol小,是否与不含P-gP抑制剂相关?
(2)血液系统不良反应:在不良反应发生率的统计中[1],Abraxane在血液系统的不良反应(贫血、血小板减少、白细胞减少、血红蛋白减少、白蛋白减少等)的发生率均高于Taxol。其中Abraxane贫血共计98%,其中3~4级28%;Taxol共计91%,3-4级7%。Abraxane血小板减少68%;Taxol55%。Abraxane白细胞减少89%;Taxol 83%。Abraxane白蛋白减少82%;Taxol72%。详见表2。
| 表1 Abraxane(100 mg/m2)或Taxol(200 mg/m2) 与卡铂联用因不良反应致用药剂量减少发生率的比较 | ||||
| 项目 | 发生率(%) | |||
|---|---|---|---|---|
|
Abraxane(100 mg/m2) +carboplatin(AUC=6 mg•min/ml) |
Taxol(200 mg/m2) +carboplatin(AUC=6 mg•min/ml) |
|||
| 贫血(血红蛋白减少) | 共计(1-4级) | 3-4级 | 共计(1-4级) | 3-4级 |
| 98 | 28 | 91 | 7 | |
| 血小板减少 | 68 | 55 | ||
| 白细胞减少 | 89 | 83 | ||
| 白蛋白减少 | 82 | 72 | ||
Abraxane给药剂量比Taxol小,但血液系统的不良反应发生率反而更高,且由于中性粒细胞减少、血小板减少、贫血等副作用导致患者必须降低剂量的发生率较高。由此可见,Abraxane的血液系统毒副作用更强。且Abraxane导致白蛋白减少的发生率高于Taxol,是否由于Abraxane中的白蛋白构象发生了变化?
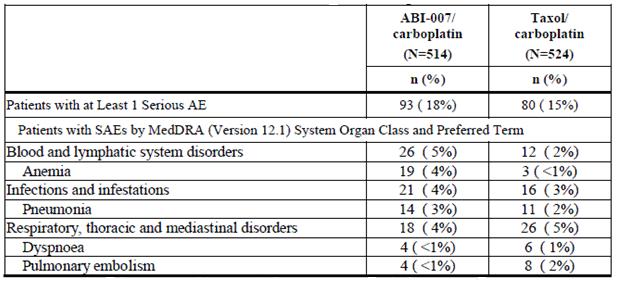
(3)严重不良反应:在严重不良反应发生率统计[1]中,Abraxane的严重不良反应发生率高于Taxol(18% vs.15%)。其中,严重贫血发生率Abraxane显著高于Taxol(4% vs. <1%)。
| 表3 Abraxane(100 mg/m2)或Taxol (200 mg/m2)与卡铂联用严重不良反应发生率的比较 |
|
(4)Abraxane和Taxol单一给药不良反应比较:1项单独接受Abraxane(260 mg/m2)或Taxol(175 mg/m2)治疗转移性乳腺癌的随机对照试验结果显示,Abraxane的感觉神经病变的发生率显著高于Taxol(普通71% vs. 56%,严重10% vs. 2%),且心电图异常、乏力、恶心、呕吐、腹泻等发生率也高于Taxol[1]。详见表4。
| 项目 | 表4 Abraxane或Taxol在治疗转移性乳腺癌的随机对照试验中不良反应的比较 | |
| Percent of Patients (%) | ||
|---|---|---|
| Abraxane 260 mg/m2 over 30 min (n=229) |
Taxol 175 mg/m2 over 3h (n=225) |
|
| Sensory Neuropathy | ||
| Any Symptoms | 71 | 56 |
| Severe Symptoms | 10 | 2 |
| Abnormal ECG | 60 | 52 |
| Asthenia | ||
| Any Symptoms | 47 | 39 |
| Severe Symptoms | 8 | 3 |
| Nausea | ||
| Any Symptoms | 30 | 22 |
| Severe Symptoms | 3 | <1 |
| Vomiting | ||
| Any Symptoms | 18 | 10 |
| Severe Symptoms | 4 | 1 |
| Diarrhea | 27 | 15 |
尽管药物学家们试图通过改变紫杉烷类的配方除去聚氧乙基蓖麻油或吐温80助溶剂,但除了白蛋白制剂外,其他所谓新制剂采用的新材料,均具有上述助溶剂同等甚至更大的副作用。而白蛋白制剂在制备过程中不可避免地会改变蛋白质空间结构,可能产生其他毒性。通过比较Abraxane与Taxol的不良反应,Abraxane在用药剂量更低的情况下,血液系统的毒副作用更强,似乎验证了上述猜想。
[1] FDA. Abraxane paclitaxel protein-bound particles for injectable suspension[EB/OL]. [2012-10-11] https: // www.accessdata.fda.gov / drugsatfda_docs /nda / 2012 / 021660Orig1s031.pdf.