召与不召——缬沙坦事件新闻稿述评
夏也今年,2018年7月5日发端的关于缬沙坦原料药混有N-亚硝基二甲胺(NDMA)杂质的新闻,经媒体不断披露,深度曝光,引起社会广泛关注。由于事发特别时刻,由特殊原因引起,后果又难以预测,有可能在药学史上留下不同凡响的一笔,构成意义深远的“缬沙坦事件”。NDMA属国际癌症研究机构(IARC)第2A类致癌物质,具有基因毒性。这其中到底发生了什么?根据新闻稿件笔者尝试作一述评。笔者对新闻稿的述评主要涉及但不限于专业角度。新闻稿主要源自但不限于“识林”和“蒲公英”APP,时间主要为但不限于2018年7月5日至9月26日,文字主要是但不限于中文。
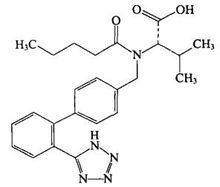
| 缬沙坦分子结构式 |
7月5日,欧盟药品管理局(EMA)发布公告称中国浙江华海药业生产的缬沙坦原料里检测出含有NDMA的致癌杂质,决定对该原料药展开评估调查,同时要求召回此原料药生产的缬沙坦制剂。此次召回行动,欧盟地区可能涉及22个国家,2300个批次。亚洲和北美洲亦有召回要求,召回已产生全球性影响。
缬沙坦是一种血管紧张素Ⅱ受体拮抗药(ARB)类的高血压病治疗药物。该药物主要使血管紧张素Ⅱ的Ⅰ型(AT1)受体封闭,血管紧张素Ⅱ血浆水平升高,刺激未封闭的AT2受体,同时抗衡AT1受体的作用,从而达到扩张血管降低血压的作用。瑞士汽巴-嘉基公司研发生产的缬沙坦商品名为“代文”,于1995年和1996年分别获得美国和欧洲的相关专利权,并于1996年7月首次在德国上市。此后陆续在欧洲、美国、日本和中国上市。汽巴-嘉基公司与山德士公司于1996年合并成立诺华公司。2014年6月27日,美国兰伯西制药公司(Ranbaxy)宣布收到FDA批准生产缬沙坦40mg、80mg、160mg、320mg片剂。这是继2012年9月诺华公司缬沙坦专利到期以来第一个仿制药许可。一项前瞻性产业研究表明,多年来代文一直是诺华旗下最畅销的药品。2010年代文的全球销售额创纪录达到60.5亿美元。此后稍有下降,至2012年全球销售额为44.17亿美元,被同是诺华公司的伊马替尼(格列卫)以46.75亿美元的销售额取代昔日霸主地位。此后缬沙坦的仿制药全球开花,进入原创药和仿制药共存时期,但仍是高血压一线主要用药。其巨大的市场需求和经济利益,使商家竞争激烈,欲罢不能。

其实,7月5日EMA公告的主要内容是浙江华海药业事前主动告知的(EMA公告称之为:The review was triggered after the company detected an impurity…)。华海药业在7月7日发布的公告称“公司在对缬沙坦原料药生产工艺进行优化评估的过程中,在未知杂质项下,发现并检定其中一未知杂质为NDMA。”科学研究告诉我们,检定未知物的成分是困难的,我们人类的一部文明史,在很大程度上就是一部发现史。对这个世界我们知道的非常之少,有时恰似盲人摸象。故尔未知杂质被成功发现并检定可谓十分不易,甚至是一种幸运。只是我们不知道华海是偶然发现的,还是刻意寻找的?为什么出现在当下?是出于什么动机或有什么背景?华海公告还说:“经调查该杂质系缬沙坦生产工艺产生的固有杂质,含量极微,且就业内采用的相同生产工艺而言,具有共性。”这是一种偏中性的略带模糊暗示和隐藏丰富内容的提法。会使非专业人士看出专业内容,也会使专业人士读出非专业成分,其关键是:证据。而证据恰恰在此时是不能随便抛出的。果不其然,北京诺华制药在7月9日一份“关于诺华制药产品不受缬沙坦制剂召回事件影响的声明”中非常谨慎表述为:“根据EMA近日发布的公告,中国某药业公司生产的缬沙坦原料药被检测出含有一种名为NDMA的致癌物杂质,EMA决定对该原料药展开评估调查。并在调查期间要求召回采用该原料药生产缬沙坦制剂。北京诺华制药有限公司特此声明:本公司的缬沙坦类药物均为原研药品,使用诺华境外生产的缬沙坦原料,因此不受上述中国某药业公司此次缬沙坦类制剂召回事件的影响……。诺华始终将患者安全和福祉放在首位,并致力于提供符合欧洲质检标准和各国卫生部门要求的高质量药物,确保中国患者获得安全有效的治疗方案,帮助患者重获健康。我们感谢您向相关医务工作者及患者转达这一重要信息!”这一声明其实就三句话:别人的事;与我无关;与我有关的是患者的安全和福祉及健康。非常专业,这是商业文书最经典套路的纯熟运用。在中国近年大规模进行仿制药一致性评价研究的进程中,今年年底又是一个重要节点的现在,出现一个这样原研药与仿制药技术差别,是一种多么重要的提醒!然而华海和诺华在声明中都没有明确提及或暗示核心所在,这不仅属于商业秘密,而且这里面包藏的应该是我们最为担心的。

事情毕竟还是循着摆在桌面上的方向发展。7月13日美国FDA宣布自愿召回清单。FDA表示:“NDMA的存在是出乎意料的,被认为与原料药的生产方式变化有关。”同时, FDA药品审评与研究中心(CDER)主任Janet Woodcock认为:“我们现这些公司销售的缬沙坦产品不符合我们的安全标准,这就是为什么我们要求这些公司立即采取措施保护患者。”这一表态异乎寻常,被一位具有30多年美国制药业的高管关注并解读为:“缬沙坦事件中美国FDA耐人寻味的行动”。药品召回,一般认为是监管机构在发现某种上市药品出现了可能的安全隐患时采取的紧急应对措施的一种。在欧美非常多见,根据美国FDA数据显示,2017年受美国FDA监督的药品有1075次召回发生。我国药品监督管理行政部门曾明确定义药品召回为:指药品生产企业按照规定的程序收回已上市销售的存在安全隐患的药品。已经确认为假药、劣药的,不适用召回程序。而在美国,召回通常是企业发起的, FDA一般不会下令召回,除非特殊情况或得到法庭判令。这一次FDA先于企业发布公告,并在其后7月18日再次通告并首次声明:这是一级召回(FDA将召回分为三级,一级召回为最严重召回),说明是极其严重的召回事件。接着,这位高管也以不寻常的积极表现说:“FDA在这次召回中不寻常的积极表现,到底是出于政治舆论压力还是另有隐情,目前不得而知。”因为这其间,8月10日FDA在其官网公布了两份分别于2016年11月和2017年5月签发给浙江华海药业的FDA483报告。FDA483报告(缺陷报告),也称现场观察报告(Inspectival observation)。它是FDA检查官根据cGMP规范,对医药企业的质量体系进行现场检查过程中所发现的不符合cGMP列出的总结清单。也有防止FDA在没有预先通知的情况下对企业进行法律制裁的文本告知含义。那张表格在FDA的编号是第483号表格,一般简称为483。舆论一时认为此时FDA公布这两份483意味深长,感觉是缬沙坦事件风波再起。一则可能FDA在审查相关的问题后主动公布的,也可能是社会各界通过美国信息自由法案(FO1A)向FDA申请索取这两份483的频率增加的后果。总之,两份483一出台,再次引发西方媒体对中国原料药生产数据可靠性的热议。而这种热议经此导向有如火借风势。2016年的483有4个观察项,包括未能遵守防止污染的书面程序,清洁和消毒设备系统缺陷及“未能同步记录”数据。2017年的483则质疑了公司分析检测的可靠性和设施设备未能得到维护以保证产品的质量属性以及认定超标结果无效的过程缺乏充分的科学论证。所有这些足以说明情况的严重性,分析来看,有的事微,有的事大。事微的没做好其责任和后果有时比事大的还要大,事大的做不好说明存在能力和实力问题,总之都很不妙。具有非常目的,FDA于此时展现了作为世界一流药品监督机构的责任所在和技术能力,在8月22日发布了GC/MS顶空检测法检测并定量缬沙坦API(Active pharmaceutical Ingredient)中NDMA的技术方法。
大约一周后的8月30日,在FDA新闻公告上FDA局长Scott Gottlied M.D和药品审评和研究中心主任Janet Woodcock,M.D先生再次就缬沙坦事件发表联合声明。这一中文达5000字的声明,以两位FDA要员的名义发布,表达了一个多月来FDA对此事的重视程度和工作力度非常罕见。声明用大量篇幅论述了对美国公众风险所做的充分评估,以及对于公众担忧的主动、及时和广泛的响应。试图以数据说话,以理服人,其耐心、委婉、专业,都说明经过深思熟虑,似一份教科书式的FDA行动报告。声明很长,开场白和中心内容都甚为微妙:“数百万美国人每天服用药物来控制血压。我们最近发现一种药品——缬沙坦的一些仿制产品含有不符合FDA安全性标准的杂质……在我们的调查确认该杂质的标本原因之际,我们希望借此机会向公众说明我们寻找杂质原因、防止此类事件的再次发生以及保护需要此药的患者所做的事情。6月19日,一家缬沙坦产品的美国生产商Prinston制药公司就其含有由浙江华海药业生产的缬沙坦原料药(API)的产品问题联系FDA药品评审与研究中心(CDER)。Prinston告知CDER他们已经停止生产缬沙坦产品,因为华海在API中发现一种杂质——一种名为NDMA的化学物质。NDMA是一种可能致癌化学物,在水和一些食物中有痕量存在。华海缬沙坦API中的NDMA水平虽仍是痕量的,但是不可接受的。”如此看来,在7月5日EMA公告之前,FDA就已知情,而且极为谨慎地启动了调查,他们认识到必须找到几个重要问题的答案,于是在声明中发问:“有多少美国缬沙坦产品受到影响?杂质从何而来?杂质的潜在健康后果如何?有多少患者受到影响?患者接触NDMA多长时间?我们如何确保告知患者和医护人员,以便最大限度地降低医疗保健的中断?如何防止药品短缺?类似的药是否也含有这种杂质?”他们在声明中还似乎对FDA的工作流程进行了检讨:“根据 FDA 的长期政策,生产商需要检测其生产工艺中可能引入或产生的杂质。我们审评产品申请(包括生产工艺变更申请)中的这些信息。作为我们新成立的药品质量办公室的一部分,我们拥有强大的有机化学家团队来审评申请和所引用的信息,查找可能引入这些风险的步骤和生产变更。FDA 还检查全球生产场地,在日常 cGMP 检查中,我们可以审查有关杂质检测的生产商记录。但是,对于记录的审查取决于是否有适当的检测来发现杂质。而检测的选择基于对生产工艺可能会生成哪些杂质的评估。换而言之,需要先认识到杂质可能出现的风险,才能知道应该对杂质进行检测。对这些风险的认识是基于对药品生产中涉及到的化学知识的深刻理解,以及一种杂质可能是原料药生产中所使用的必要步骤的副产物的理论风险。当识别出这些杂质时,有多种方法可以重新设计生产工艺以找到不会产生这些副产物的路径。因为并未预计到 NDMA会在缬沙坦 API 生产中达到如此水平,所以生产商不会对其进行检测。也就没有可以在检查中帮助发现该问题的文件记录。因此这一特殊风险就无法在现场检查中发现。随着我们对 NDMA 形成的根本原因有了更好的了解,并开发了在缬沙坦或其他 ARB 药物中检测 NDMA 的方法,我们可以确保在将来实施适当检测。”

他们的这份声明,以第一人称给出,感觉十分亲切。科普、专业和责任相互兼顾,公众看得懂,专家信得过。对哗然的舆情自然是一剂良药,一方面扭转对FDA在此事件的作为上持不同看法的方向,另一方面使一个经过精心设计的积极努力与科学负责的监管机构形象跃然纸上。
来到9月,一叶落而知天下秋。“缬沙坦事件”伴随着在加拿大和美国的诉讼似乎进入中途加速跑。《英国医学杂志》(BMJ)于 9 月 12 日公布了一项丹麦全国性队列研究的结果,报告了使用 NDMA污染的缬沙坦的癌症风险。研究关注了 5150 名没有癌症史的丹麦患者,他们至少从 2012 年或之后开始使用缬沙坦。队列的中位暴露时间为 4.6 年。研究未发现任何显著增加的短期癌症风险。但研究结果表明结肠直肠癌和子宫癌的风险增加但在统计学上不显著,可能需要进一步研究。研究无法验证长期癌症风险。因此,研究人员得出结论,有必要进一步研究以评估长期癌症风险。BMJ 论文认为,在整个欧洲层级的积极药物警戒研究结果可能有助于澄清对缬沙坦安全性的影响。“如果将丹麦的研究扩展到更大的欧洲人群,我们可能已经有了确凿的答案。” 这一研究也支持了欧洲药品管理局(EMA)对于 NDMA 杂质致癌风险的估计。根据对华海药业缬沙坦 API 的最新检测结果,EMA 估计,对于连续6年(自企业 2012 年最早使用产生杂质的新生产工艺之时算起)每天服用 320mg 的成年人,NDMA 的终生癌症风险为五千分之一。EMA 表示五千分之一的风险级别“被视为是低风险”。但这仍然比 ICH M7(R1) 关于致突变杂质毒理学阈值指南中终身癌症风险十万分之一的理论值高出 20 倍。美国 FDA 的类似估计为八千分之一。
9月13日,美国FDA和EMA双双发布公告,在缬沙坦中发现了另一亚硝胺杂质——N-亚硝基二乙胺(NDEA)。监管机构表示,浙江华海药业2012年变更为新生产工艺之前的缬沙坦API中已经检测出NDEA。NDEA也具有已知的动物和人体致癌性。FDA表示与NDMA一样NDEA亦是在生产步骤和化学反应的特定序列中形成的。
由此看来,缬沙坦事件以其多面性和复杂性使公众或者新闻媒体对其走向评估忙无头绪,明天还真的不知道会发生什么。但会提醒我们,药作为一门高端科学会不会统摄我们的思维方式?人类还能不能解释清楚药出现的种种现象?与“缬沙坦事件”几乎同时出现的两件事似乎值得一提:美国正在实施对中国的贸易战。另一件是作为美国政府部门的美国卫生部国家健康研究院(NIH)院长柯林斯教授于8月20日致信全美一万多家机构,声称国外实体机构开始系统计划影响NIH资助的研究者,建议各机构与当地美国联邦调查局(FBI)谈话。这是人类历史上第一次由科学家公开邀请FBI机构进入监控举动。对此北京大学理学部主任、哲学博士、著名生物学家饶毅教授于于8月28日致信柯林斯院长:科学家应该有脊梁。
可以说,在这样一个千载一遇的大变局下,中国制药走到历史上最困难的也是最有希望的时期。关键是吃这一碗饭的我们药师有没有真本领、大智慧和硬脊梁,兑现二千多年前孟子老先生的著名预言:“必有所不召之臣”。
2018年9月26日 于淝上