国家药监局:将对“中药伤肝”全周期监测与管控
周亦川
为控制中药用药的安全风险,推动中药新药研发,促进中药产业健康发展,2018年6月19日下午,国家药监局官网发布了《中药药源性肝损伤临床评价技术指导原则》(下称《指导原则》),是我国首个针对药品全生命周期(临床前、临床试验期间、上市后)的肝损伤进行风险识别和评估的指导文件。

据悉,药源性肝损伤是常见的药物严重不良反应之一,重者可致急性肝衰竭甚至死亡;药源性肝损伤也是国内外药物研发失败、增加警示和撤市的重要原因。
与此同时,当前国内外药源性肝损伤的临床诊断和研究方法主要是针对临床医师的临床诊断而研制,对于新药研发中的中药药源性肝损伤的临床评价均具有一定局限性。
在此背景下,国家药监局自2017年11月7日正式启动《指导原则》编制工作,并于2018年3月16日开始网上公示,4月27日召开指导原则定稿会,历经6个月最终形成正式稿。中药药源性肝损伤因果关系评估是此次编制工作的重点及亮点。

据国家药监局发布文件显示,与临床诊断不同,在中药新药研发过程中,对疑似肝损伤的评价需要尽可能得到明确的因果关系结论,也即在明确诊断为药源性肝损伤的基础上,其目的不仅要甄别患者肝损伤是否由中药所致,而且还要甄别是否由所评估中药所致。
因此,《指导原则》强调了中药药物因素的影响,包括中药材、中药饮片的来源、炮制和质量;强调了处方合理性,包括配伍、用量、用法、品规、调剂和方证相应等方面。
值得注意的是,《指导原则》以肝损伤风险信号作为串联药品全生命周期监管的具体抓手:既注重从临床前、到上市前、再到上市后评价阶段的肝损伤风险信号“正向”传导,指导新药研发进程;又注重从临床阶段发现的肝损伤风险信号的“反向”传导,开展实验室再评价研究,通过基础研究证据对所发现的肝损伤风险信号进行科学确认。
根据《指导原则》,具体防控措施包括密切观察、调整治疗方案或停药、临床试验中止、修改说明书、限制流通和使用、药品撤市等,以实现中药安全性风险全生命周期监测与管控,保障受试者的安全。
文中指出,药源性肝损伤,亦称药物性肝损伤(Drug-induced liver injury,DILI),是指由药物本身及/或其代谢产物等所导致的肝脏损伤,为临床常见的药物不良反应之一,严重者可致急性肝衰竭甚至死亡。药源性肝损伤已成为药物研发包括中药研发失败、增加警示和撤市的重要原因,受到医药界、制药业、管理部门及公众的高度重视。
数千年来,中医药为中华民族防病治病与繁衍生息作出了历史性贡献,至今仍发挥着难以替代的作用。随着中药在全球范围内的广泛应用,药品不良反应监测体系的不断完善以及人们对药品安全问题越来越重视,近年来以药源性肝损伤为代表的中药不良反应/事件频发,为中药新药研发、中药产业健康发展及临床安全用药带来了重大挑战。
长期以来,由于缺少特异性诊断指标,药源性肝损伤主要采取排除性诊断,误诊率和漏诊率较高。中药因其本身复杂性、研究基础薄弱、联合用药较普遍等因素,其肝损伤往往较为隐匿,肝损伤与中药的因果关系难以厘清,加之人们对中药存在“天然、无毒副作用”等认识误区,研发者和企业对药品不良反应尚未予以足够的重视,中药安全性风险防范与控制难度大。因此,亟需建立一套科学、客观的中药药源性肝损伤评价与风险防控技术体系,从而更好地发现、规避和防范中药药源性肝损伤风险。
中药的肝损伤问题一直为世界所瞩目,2017年10月18日《科学:转化医学(Science Translational Medicine)》发布的一篇研究显示,多种中药中含有的“马兜铃酸”及其衍生物与台湾地区以及亚洲肝癌高发密切相关。其中,针对台湾地区肝癌患者的基因测序结果显示,78%的患者,罹患肝癌可能是马兜铃酸所致。针对大陆地区的研究数据显示,48%的肝癌患者可能归因于马兜铃酸。这篇文章被推荐至杂志封面,评价为“一种中草药的黑暗面”,部分外媒更是以《传统中药可能导致肝癌》为标题。
《原则》的数据也证明了这一问题。根据国外发表的流行病学数据,药源性肝损伤在普通人群中的发生率估计介于1/100000-20/100000。来自美国药物性肝损伤网络研究数据显示,草药和膳食补充剂引起的肝损伤快速增加,其肝损伤构成比从2005年7%陡升至2012年19%。来自亚太的数据显示,中草药是韩国和新加坡引起药源性肝损伤最为主要的药物。我国较大样本的单中心和多中心临床回顾性研究表明,中药药源性肝损伤在全部药源性肝损伤中的构成比约为20%。
《原则》指出中药药源性肝损伤的风险因素较为复杂,应从药物和机体及其相互作用等方面分析,特别是特异质型肝损伤应考虑免疫、代谢、遗传等机体因素的影响,以便更有针对性地获取肝损伤风险因素信息。
《原则》建议,将中药肝损伤分为药物因素、机体因素、临床用药因素及其他因素四个方面考虑:
1 中药材、饮片及辅料的来源和质量同名异物、掺杂使假、炮制加工不当等常常是影响中药药源性肝损伤评价的重要干扰因素,在评估药物肝损伤时需要对原材料的质量有统一标准。
2 肝损伤相关风险物质,包括中药的原型成份以及体内生成的药物代谢产物,应加以综合评价。
3 配伍禁忌,从安全用药角度,中药处方需注意“相恶”“相反”等配伍禁忌。如果处方涉及配伍禁忌,研发者需提供必要的研究证据证实其合理性及安全性。
4 改变给药途径和剂型,特别是外用改为内服、局部用药改为全身用药、口服给药改为注射用药等,可能增加安全性风险。新型释药技术或新型给药系统亦可能会增加肝损伤风险。
在机体因素中,应考虑到个体肝损伤易感性,一些免疫功能较差的人可能出现肝损伤。特殊人群包括儿童、高龄人群、妊娠期和哺乳期妇女等应特殊考虑。有基础肝病患者应评估是药物还是疾病本身造成的肝损伤。
用药的剂量和疗程,方证相应,联合用药等临床用药方式也可能导致药源性肝损伤,在调查分析中药相关肝损伤不良反应时,不能孤立地看待中药处方的组成、功效及合理性,还应考虑在治疗实践中不同治疗手段之间、不同药物之间的相互作用。
酒精、染发剂、装修污染和其他环境毒物等也可能导致肝损伤,应排除其造成的干扰。

《原则》指出,充分收集中药药源性肝损伤的风险信号,有助于实现中药药源性肝损伤风险的早发现、早防控。
中药药源性肝损伤的相关风险信号包括常见的临床表现包括乏力、食欲减退、恶心、厌油、小便深黄或褐、上腹部胀痛、肝区不适等;在生化指标方面,主要指标有反映肝细胞损伤的丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST);
其他在肝组织病理表现,如肝细胞变性坏死、炎细胞浸润、纤维组织增生、胆管损伤和血管病变等非特异性病理改变,以及B超、计算机断层扫描(CT)或核磁共振成像(MRI)等影像学检查可作为药源性肝损伤风险信号收集的辅助手段。
另外,目前尚未有公认的可用于药源性肝损伤鉴别诊断的生物标志物,但细胞角蛋白18(CK-18)、高迁移率族蛋白B1(HMGB1)等特异性生物标志物的筛选和开发是药源性肝损伤临床评价值得期待和鼓励的。
《原则》要求,中药药源性肝损伤风险信号的收集应贯穿药品研发、生产和使用的全过程。新药研制方、药品上市许可持有人等相关机构和人员应从文献信息、临床前安全性评价、临床试验及上市后评价等方面收集中药药源性肝损伤风险信号,充分利用我国各级药品不良反应和合理用药监测机构、医疗和科研机构等药品安全性相关数据,全面了解其安全性潜在风险。
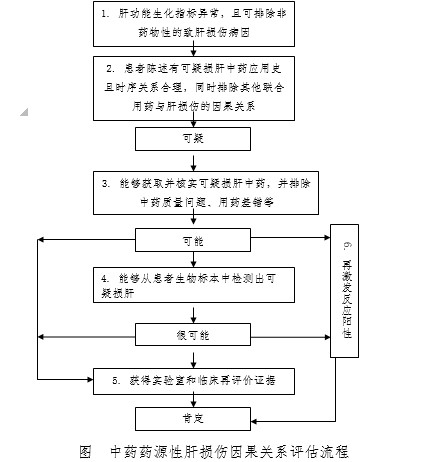
《原则》提到,因果关系评估是中药药源性肝损伤临床评价的关键,也是中药药源性肝损伤风险防控的基础。在本指导原则中,中药药源性肝损伤因果关系评估包括三个层级:一是肝损伤与药物的关系;二是肝损伤与中药的关系;三是肝损伤与某种中药的关系:
1 肝脏生化实验异常,且可排除非药物性致肝损伤病因。
2 患者陈述有可疑损肝中药应用史且时序关系合理,同时评估其他联合或序贯用药与肝损伤的因果关系。
3 能够获取并核实可疑损肝中药,同时排除中药质量问题、用药差错等。
4 能够从患者血清、尿液、肝脏组织或毛发等生物标本中检测出可疑损肝中药的原型成份和/或代谢产物。
5 获取实验室和临床再评价证据。采用多种毒理学和组学等手段,包括关联临床病证的中药安全性评价模型和方法,获得实验室再评价证据;采用前瞻性和回顾性临床研究,结合临床生物标本分析,获得临床再评价证据。
6 发生再激发反应。药物再激发反应阳性是可靠的药源性肝损伤因果关系临床评价依据,但再激发反应阴性不能作为排除药源性肝损伤的证据。
依据以上6项评估内容,可将中药药源性肝损伤因果关系评估分为五级:排除、可疑、可能、很可能、肯定,评估标准如下:
可疑:(1)+(2);
可能:可疑+(3);
很可能:可能+(4);
肯定:很可能+(5)或(6);可能+(5)或(6);
以下情况因果关系评估为“排除”:肝损伤的因果关系可归因于明确的非药物性致病因素;肝损伤发生与所评估中药的服药时间顺序关系不合理;肝损伤的因果关系可归因于所评估中药以外的其他药物。
简图如下:
《原则》要求,对有肝损伤风险的中药,根据其临床治疗价值以及肝损伤发生率或报告例次、损伤程度、临床分型、预后情况等,结合患者体质、治疗目的、可替代药物情况等,开展临床和实验室再评价,进一步确证肝损伤风险信号和肝损伤类型,阐明易感人群、风险物质、损伤机制及影响因素,系统考察中药风险与获益情况。中药上市前需制定其风险控制措施,包括密切观察、调整治疗方案或停药、临床试验中止等。
中药新药上市后使用人群广泛,用药情况复杂,针对新药上市前临床试验周期短、风险信号未充分暴露的不足,可通过上市后长时间和大规模人群监测,收集其可能的肝损伤风险信号,并及时确认信号和处置风险。
中药新药上市后,应避免超适应症使用、超剂量使用、超疗程使用以及超人群用药。尤其应注意特殊人群(妊娠期妇女、儿童、老年人等)以及超临床试验受试者年龄范围人群的用药安全性风险。此外,要注意防止用药差错。
针对确有肝损伤风险的中药,需药品上市许可持有人、生产经营企业、药品安全监管部门共同进行药品肝损伤的监控管理。当该药的获益大于风险时,最常见的风险管理手段是修改药品说明书,提高警示,并加强医护人员、药师的教育,并建议对用药者进行定期或不定期的肝功能监测。
针对已明确可诱发肝损伤的中药,可修订产品的风险控制措施,采取限制使用的方法,以控制医疗机构或人群使用这类药品时可能引起的风险。如果发生严重药品不良事件,通过上述措施依然不能有效解决药品安全性风险,且该产品从市场退出不会明显影响到相关适应症领域的治疗现状,国家药品监管机构可以依法暂停其生产销售或直接取缔产品批准文号。
在《<中药药源性肝损伤临床评价技术指导原则>起草说明》中指出,我国的医药卫生保障条件存在一定的资源配备不平衡问题,大众对于中药的安全性防范意识较为薄弱,药品安全风险防控能力建设相对滞后。因此,亟需建立一套符合中国国情和中药特点的药源性肝损伤风险评价与管理体系,以指导和帮助中药研发、审评、监管、使用相关人员,有效捕捉和识别中药药源性肝损伤风险信号,科学厘定患者肝损伤与中药之间的因果关系,系统评价相关中药的安全性及风险获益比,有针对性制定中药药源性肝损伤的风险控制措施,提高中药新药研发的成功率,实现中药产品全生命周期安全性风险管控,促进我国中医药产业健康持续发展。